Un soutien pour vos besoins en matière de tests et de biomarqueurs contre la COVID-19
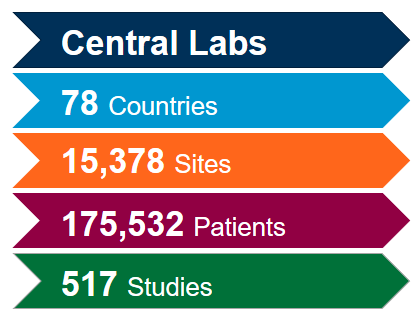
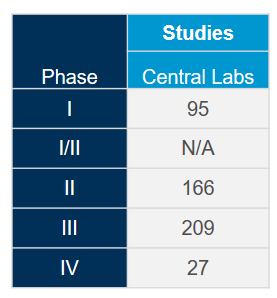
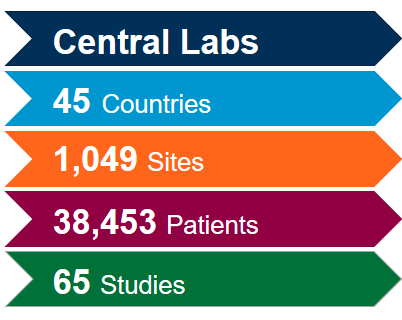
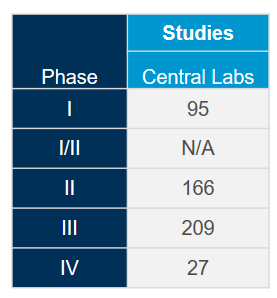
Tirez le plus de valeur de notre réseau mondial de laboratoires centraux intégrés avec l'aide de nos experts scientifiques et opérationnels. Forts d'une riche expérience issue de plus de 4 400 essais cliniques réalisés au cours des cinq dernières années, tous domaines thérapeutiques confondus, nous savons comment optimiser vos études et éviter les problèmes potentiels afin de respecter le rythme rapide attendu pour les études sur le coronavirus (COVID-19).